パイプライン
医薬開発領域
医薬開発領域においては、当社グループ独自での開発及び製薬企業との提携による開発を、以下の通りそれぞれ進めております。
低分子医薬
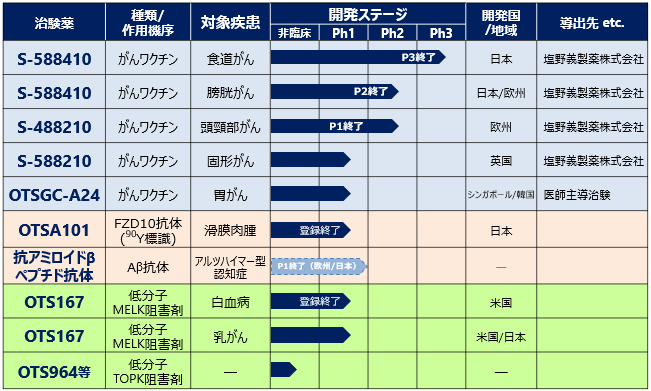
がん幹細胞の維持に重要なリン酸化酵素(キナーゼ)であるMELK(Maternal Embryonic Leucine zipper Kinase)を標的としたOTS167については、乳がんに対する第Ⅰ相臨床試験を米国及び日本国内で実施しております。この臨床試験は、トリプルネガティブ乳がんを含む乳がんの患者さんを対象とし、OTS167のカプセル剤による経口投与における安全性及び推奨投与量の確認を主目的とし、副次的にトリプルネガティブ乳がんに対する臨床上の有効性を確認するものです。なお、米国で実施しておりました急性骨髄性白血病に対する第Ⅰ/Ⅱ相臨床試験は患者登録が終了し、OTS167の静脈内反復投与における安全性が確認されています。また、オーストラリアで実施しておりました健常成人を対象とした経口投与による消化管吸収性(バイオアベイラビリティ)の確認を主たる目的とする臨床試験において、ヒトでの良好な経口吸収性が確認されています。
OTS167の標的であるMELKは、がん幹細胞に高発現し、その維持に重要な役割をしているリン酸化酵素(キナーゼ)です。OTS167は、そのキナーゼを阻害し、強い細胞増殖抑制効果が期待できる新しい作用機序(ファースト・イン・クラス)の分子標的治療薬であり、既に動物試験において、肺がん、前立腺がん、乳がん及び膵臓がん等に対し、強力な抗腫瘍効果が確認されています。
また、細胞分裂に重要ながん特異的新規標的分子(TOPK)に対する複数の最終化合物を同定しております。動物実験で、顕著な結果が得られたことから、製剤化検討及び非臨床試験を進めております。
がんペプチドワクチン
がんペプチドワクチンにつきましては、提携先製薬企業との戦略的対話を促進し、提携先が実施する臨床開発の側面支援、後方支援を強化して参りました。
当社が塩野義製薬株式会社にライセンスアウトしているがん特異的ペプチドワクチンS-588410について、食道がん患者さんを対象とした第Ⅲ相臨床試験を塩野義製薬株式会社が実施し、完了いたしました。本試験の主要評価項目である無再発生存期間(RFS)に関して、S-588410群とプラセボ群の比較では、S-588410群におけるRFS延長について統計学的な有意差は認められませんでした。一方で、食道がん発生部位別又はリンパ節転移グレード別の探索的な部分集団解析では、S-588410投与により上部胸部食道がんの患者さん集団で全生存期間(OS)が有意に延長され、またリンパ節転移が多い患者さん集団ではRFSやOSの改善が認められる傾向を確認しております。また、副次評価項目の1つである細胞傷害性Tリンパ球(CTL)誘導に関してはS-588410投与により高い誘導率が確認され、主な副作用は注射部位の皮膚反応であり、重篤な皮膚反応は認められませんでした。本試験で得られた結果についてはさらに詳細な解析を行い、今後のがんペプチドワクチン開発方針の一助にする予定であります。今後の開発計画については、契約締結先である塩野義製薬株式会社と協議を継続して参ります。なお、塩野義製薬株式会社は、S-588410の食道がん第Ⅲ相臨床試験の他、膀胱がんを対象としたS-588410について日欧で第Ⅱ相臨床試験を完了しており、頭頸部がんを対象としたS-488210は欧州で第Ⅰ/Ⅱ相臨床試験を、また、固形がんを対象としたS-588210は英国で第Ⅰ相臨床試験を、それぞれ実施しております。
また、シンガポールのNUH(National University Hospital)及び韓国のYonsei University Health System,
Severance Hospitalにて、胃がんを対象としたがんペプチドカクテルワクチンOTSGC-A24と免疫チェックポイント阻害剤オプジーボの併用第Ⅰ相試験を、医師主導治験として実施しております。
抗体医薬
がん治療用抗体医薬OTSA101については、日本における滑膜肉腫に対する第Ⅰ相臨床試験を実施しておりましたが、患者登録が終了致しました。本試験は、難治性又は再発性の滑膜肉腫患者を対象に、放射性同位元素を結合したOTSA101投与における安全性及び体内薬物動態の確認を主たる目的とするもので、第Ⅰ相の主目的である111In標識OTSA101投与後の安全性及び90Y標識OTSA101投与後の安全性・忍容性が確認されました。
また、当社連結子会社であるイムナス・ファーマ株式会社は、抗アミロイドβペプチド抗体のライセンスアウト活動を進め、アルツハイマー型認知症の治療薬を提供することを目指しております。なお、2024年2月5日に公表したとおり、当社は、当社100%子会社であるイムナス・ファーマ株式会社を吸収合併することと決議しております。
※原則、2023年12月31日現在の状況で記載しております。
ページの上部へ
